1. Introducción
La tabla periódica de los elementos es una de las herramientas más fundamentales en el campo de la química. Desde su creación en el siglo XIX, ha servido como un mapa esencial que organiza y clasifica todos los elementos conocidos en el universo. Este artículo explorará la historia, la estructura, y las aplicaciones de la tabla periódica, así como las tendencias y el futuro de este importante recurso científico.

1.1 Historia y origen de la tabla periódica
La tabla periódica fue creada por Dmitri Mendeléyev en 1869. Su disposición de los elementos, basada en el peso atómico, permitió predecir la existencia de elementos aún no descubiertos. Este invento revolucionó la química, proporcionando un marco para comprender las propiedades y las relaciones entre los diferentes elementos.
1.2 ¿Qué es la tabla periódica?
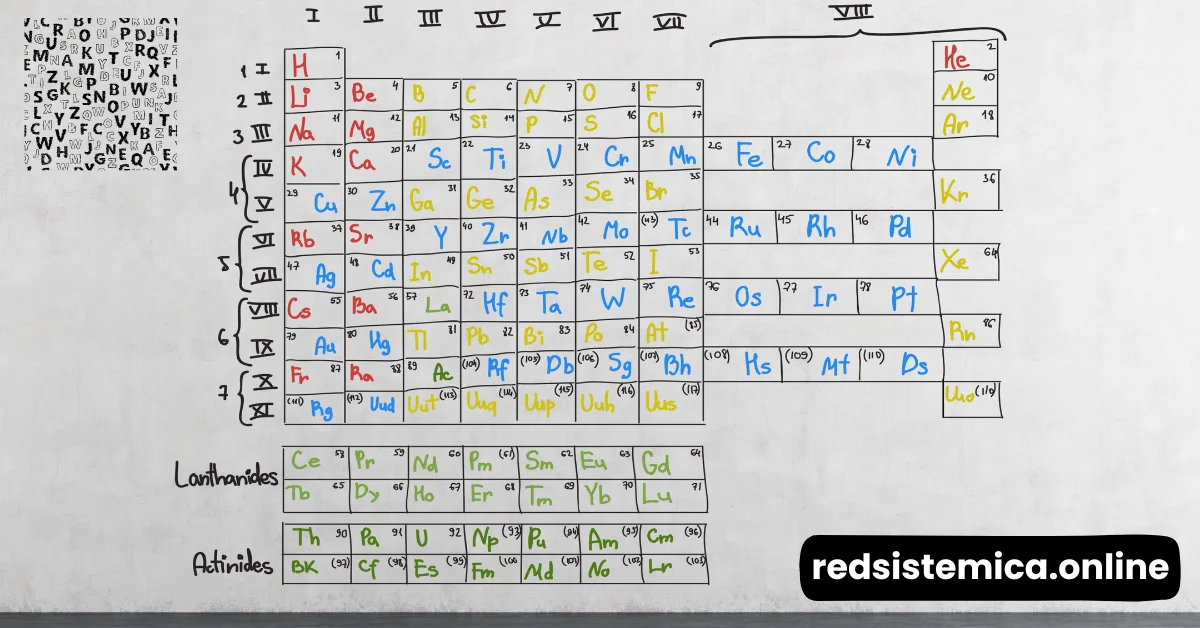
La tabla periódica es una disposición tabular de los elementos químicos, ordenados por su número atómico, configuración electrónica, y propiedades químicas recurrentes. Su estructura permite a los científicos predecir el comportamiento de los elementos y sus compuestos.
2. Estructura de la Tabla Periódica
La estructura de la tabla periódica es más que una simple lista; es un arreglo que refleja las propiedades fundamentales de los elementos.
2.1 Grupos y períodos
Los elementos en la tabla periódica están organizados en grupos (columnas) y períodos (filas). Los grupos comparten propiedades químicas similares, mientras que los períodos indican el nivel de energía de los electrones.
2.2 Bloques de la tabla periódica
La tabla periódica se divide en bloques según la subcapa electrónica que está siendo llenada: s, p, d, y f. Cada bloque tiene características distintivas que influencian las propiedades de los elementos que contiene.
2.3 Elementos representativos y de transición
Los elementos representativos se encuentran en los grupos 1, 2, y 13-18, y suelen seguir reglas químicas predecibles. Los elementos de transición, en cambio, se ubican en los grupos 3-12 y muestran una variedad de estados de oxidación y propiedades físicas.
3. Elementos de la Tabla Periódica
La tabla periódica clasifica los elementos en tres grandes categorías: metales, no metales, y metaloides.
3.1 Metales
Los metales, que ocupan la mayor parte de la tabla, son elementos que suelen ser buenos conductores de electricidad y calor. Son maleables y dúctiles, y muchos de ellos tienen aplicaciones industriales cruciales.
3.2 No metales
Los no metales, situados en la parte superior derecha de la tabla, incluyen elementos esenciales para la vida como el oxígeno y el carbono. Estos elementos suelen ser malos conductores y tienen una mayor tendencia a ganar electrones.
3.3 Metaloides
Los metaloides poseen propiedades intermedias entre metales y no metales. Son cruciales en la industria de los semiconductores, ya que su capacidad de conducir electricidad puede ser ajustada mediante dopaje.
4. Propiedades de los Elementos
Las propiedades de los elementos pueden clasificarse en físicas y químicas, y estas son fundamentales para su comportamiento en diferentes reacciones.
4.1 Propiedades físicas
Las propiedades físicas incluyen características como el punto de fusión, densidad, y conductividad térmica. Estas propiedades varían sistemáticamente a lo largo de la tabla periódica.
4.2 Propiedades químicas
Las propiedades químicas, como la reactividad y el estado de oxidación, son clave para entender cómo los elementos interactúan entre sí. Estas también muestran tendencias a lo largo de la tabla periódica.
5. Tendencias en la Tabla Periódica
La tabla periódica revela varias tendencias en las propiedades de los elementos que son vitales para su comprensión.
5.1 Energía de ionización
La energía de ionización, la cantidad de energía necesaria para remover un electrón de un átomo, aumenta a medida que nos movemos de izquierda a derecha a lo largo de un período.
5.2 Electronegatividad
La electronegatividad, una medida de la capacidad de un átomo para atraer electrones, también sigue una tendencia ascendente de izquierda a derecha en un período, alcanzando su máximo en los no metales.
5.3 Radio atómico
El radio atómico, la distancia desde el núcleo hasta el electrón más externo, disminuye de izquierda a derecha a lo largo de un período, pero aumenta al bajar en un grupo.
6. Aplicaciones de la Tabla Periódica
La tabla periódica no solo es un recurso teórico; tiene aplicaciones prácticas en diversas áreas.
6.1 Uso en la química industrial
En la industria química, la tabla periódica es utilizada para formular compuestos y predecir reacciones. Por ejemplo, la catálisis en procesos industriales depende en gran medida de los elementos de transición.

6.2 Aplicaciones en la medicina
En la medicina, varios elementos de la tabla periódica, como el yodo y el hierro, son esenciales para la salud humana. Además, los isótopos radiactivos tienen aplicaciones en el diagnóstico y tratamiento de enfermedades.
6.3 Rol en la tecnología
Los elementos de la tabla periódica son fundamentales en la tecnología moderna. El silicio, un metaloide, es la base de la industria de los semiconductores, y los metales raros como el litio son cruciales en la fabricación de baterías de alta eficiencia.
9. Conclusión
La tabla periódica es más que un simple cuadro; es un reflejo del orden natural del universo. Desde sus humildes comienzos hasta su estado actual como una herramienta esencial en la ciencia, la tabla periódica continúa siendo un testimonio de la capacidad humana para descubrir y organizar el mundo que nos rodea. Con el avance de la ciencia, es probable que la tabla periódica continúe evolucionando, abriendo nuevas fronteras en nuestro entendimiento del cosmos.